处方药 中国
| 通用名称 | 泽布替尼胶囊、百悦泽、Brukinsa |
| 药品规格 | 80mg*64粒 |
| 生产企业 | 中国基石药业 |
| 功能主治 | 用于治疗成人慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL) |
注:泽布替尼为处方药物,外包装仅供参考,需在医生指导下使用,用药前请仔细阅读药品说明书,了解用法用量、禁忌症及不良反应。
【药品说明书】
适应症
1) 既往至少接受过一种治疗的成人套细胞淋巴瘤(MCL)患者
2) 既往至少接受过一种治疗的成人慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)患者。
分别基于一项单臂临床试验的客观缓解率结果附条件批准上述适应症,完全批准将取决于正在开展中的确证性随机对照临床试验结果
3) 既往至少接受过一种治疗的成人华氏巨球蛋白血症(WM)患者。
基于一项单臂临床试验的主要缓解率结果附条件批准上述适应症,完全批准将取决于正在开展中的确证性随机对照临床试验结果
用法用量
本品须在有血液系统肿瘤治疗经验医生的指导下用药。
应口服给药,每天的用药时间大致固定。
应用水送服整粒胶囊,可在饭前或饭后服用。
请勿打开、弄破或咀嚼胶囊。
如果未在计划时间服用本品,患者应在当天尽快服用,并在第二天恢复正常用药计划。
请勿额外服用本品以弥补漏服剂量。
推荐的泽布替尼每日口服总剂量为320mg。
给药方案为每次160mg(2 粒80mg胶囊),每日两次,直到发生疾病进展或出现不可耐受的毒性。
与 CYP3A 抑制剂或诱导剂联合给药时的剂量调整
无症状的淋巴细胞增多不应视为不良反应,出现此事件的患者应继续服用本品。
特殊人群用药
肝功能损伤
轻度至中度肝损伤患者不建议进行剂量调整。
重度肝损伤患者推荐剂量是每 次 80 mg(1 粒 80 mg 胶囊),口服,每日两次。
肾功能损伤
轻度至中度肾功能损伤患者不建议进行剂量调整。
重度肾功能损伤(肌酐清 除率 < 30 mL/min)或透析患者使用本品需监测相关不良反应。
老年用药
老年患者无需进行剂量调整。
儿童用药
本品在儿童患者中的安全性和有效性尚未确立。
不良反应
出血、感染、乙肝病毒再激活、血细胞减少症、 第二原发恶性肿瘤、心律失常、肿瘤溶解综合征、高血压。
禁忌
本品禁用于已知对泽布替尼或辅料超敏(如速发过敏和类速发过敏反应)的患者。
贮存方法
密封,30℃以下保存。
有效期
24个月
剂型
胶囊剂
生产厂家
中国基石药业
成分
本品活性成份为泽布替尼。
化学名称:(S)-7-[4-(1-丙烯酰基哌啶基)]-2-(4-苯氧基苯基)-4,5,6,7-四氢吡唑 并[1,5-a]嘧啶-3-甲酰胺
分子式:C27H29N5O3
分子量:471.55
性状
本品为白色至类白色硬胶囊,内容物为白色至类白色粉末。
注意事项
出血
在接受本品单药治疗的血液系统恶性肿瘤患者中,曾发生严重出血和致死性出血事件。
3.1%的患者发生严重出血事件,其中包括血尿和上消化道出血(各 0.4%)。
3.5%的患者发生3级或更高级别的出血事件,其中包括血尿(0.4%)、硬膜下出血(0.3%)、胃肠出血(0.3%)和胸腔积血(0.3%)。
52.8%的患者发 生任意级别的出血事件,以紫癜/瘀点/青肿和血尿常见(>10%)。
分别有0.6%、 4.6%和1.3%的患者因出血事件降低本品剂量、暂停给药和终止治疗。
出血事件的发生机制尚不清楚。
本品可能会增加接受抗血小板或抗凝治疗患者的出血风险,应监测患者的出 血迹象。
需接受手术的患者,应根据手术类型和出血的风险,进行风险获益评估, 考虑在术前和术后暂停本品 3-7 天。
如发生与治疗有关的 3 级或 3 级以上的出血或任何级别的颅内出血时,应永 久终止本品治疗。
感染
在接受本品单药治疗的血液系统恶性肿瘤患者中有致死性严重感染(包括细 菌、病毒或真菌)和机会性感染的报告。
有 26.3%患者发生 3 级或以上级别的感 染事件,其中最常见的是感染性肺炎(10.1%)。
分别有 1.5%、16.6%和 2.7%的 患者发生导致降低本品剂量、暂停给药和治疗终止的感染事件。
对感染高危患者,应考虑对单纯疱疹病毒、耶氏肺孢子虫肺炎和其他感染进 行预防治疗。
监测和评估患者是否出现发热或其他感染的症状和体征,并给予相 应治疗。
乙肝病毒(HBV)再激活
在本品单药的临床试验中有乙型肝炎病毒再激活(1.2%)报告。
在这些临床试验中,活动性乙型肝炎患者已除外。
本品对于乙型肝炎病毒再激活的影响尚不清楚。
应在使用本品前明确乙型肝炎病毒状态。
若患者目前或既往有乙型肝炎病毒感染,建议在开始本品治疗前咨询肝炎专科医师,并依据当地诊疗常规监测管 理,以防止乙型肝炎复发。
在临床试验中乙型肝炎核心抗体阳性患者须接受预防性抗乙型肝炎病毒治疗。
血细胞减少症
基于实验室检测结果,在接受本品单药治疗的血液系统恶性肿瘤患者中,血细胞减少十分常见,表现为中性粒细胞减少、血小板减少和贫血,并常见有 3 级 或 4 级血细胞减少症的报告。
常见(≥1%)患者因血细胞减少症,包括中性粒细胞减少症(8.2%)、血小 板减少症(2.3%)和贫血(1.2%)中断治疗;分别有 1.3%、0.3%和 0.1%患者因 中性粒细胞减少症、血小板减少症和贫血降低本品剂量;偶见(<1%)患者因血 细胞减少终止治疗。
在治疗期间建议密切监测全血细胞计数,如发生血细胞减少,应根据临床需 求给予对症治疗;必要时暂停用药,待相关血液学不良反应缓解至用药条件后再恢复用药。
第二原发恶性肿瘤
同类产品有发生第二原发恶性肿瘤的报道。
在接受本品单药治疗的血液系统 恶性肿瘤患者中,有12.1%发生第二原发恶性肿瘤,最常见的是皮肤癌 (8.1%) (其中包括基底细胞癌[4.5%]和皮肤鳞状细胞癌[2.8%])。
建议患者做好防晒措施。
心律失常
同类产品的临床试验和上市后观察中均报道过房颤、房扑及室性心动过速。
在接受本品单药治疗的血液系统恶性肿瘤患者中,有 2.2%的患者发生房颤或房扑事件,其中 0.6%的患者为 3 级或以上级别事件;0.6%的患者发生室性期外收 缩或室性心律失常,其中0.1%的患者为 3 级或以上级别事件。
存在心脏风险因 素、患有高血压和急性感染患者的风险可能会增加。
在接受本品治疗期间,应定期监测患者是否发生心律失常,对出现心律不齐症状(如心悸、头晕、昏厥、胸部不适或新发呼吸困难)的患者进行临床评价,根据指征要求患者接受心电图(ECG)检查。
出现心律失常时应及时调整治疗。
肿瘤溶解综合征
使用本品单药治疗时,尤其是在接受治疗的慢性淋巴细胞白血病(CLL)患者中,已有肿瘤溶解综合征个案报告。
治疗前应评估风险(如高肿瘤负荷)并采取适当的预防措施。
密切监测患者并予以适当的治疗。
高血压
在接受本品单药治疗的血液系统恶性肿瘤患者中,有10.1%的患者发生高血 压事件,其中4.0%为3级或者以上级别。
无患者因高血压导致降低本品剂量或终止治疗。
仅有1例(0.1%)患者因高血压暂停给药。
应定期监测接受本品治疗患者的血压,并酌情使用新的降压药或调整原有降压药治疗。
【适应症】
1) 既往至少接受过一种治疗的成人套细胞淋巴瘤(MCL)患者
2) 既往至少接受过一种治疗的成人慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)患者。
分别基于一项单臂临床试验的客观缓解率结果附条件批准上述适应症,完全批准将取决于正在开展中的确证性随机对照临床试验结果
3) 既往至少接受过一种治疗的成人华氏巨球蛋白血症(WM)患者。
基于一项单臂临床试验的主要缓解率结果附条件批准上述适应症,完全批准将取决于正在开展中的确证性随机对照临床试验结果
【副作用】
出血、感染、乙肝病毒再激活、血细胞减少症、 第二原发恶性肿瘤、心律失常、肿瘤溶解综合征、高血压。
【用法用量】
本品须在有血液系统肿瘤治疗经验医生的指导下用药。
应口服给药,每天的用药时间大致固定。
应用水送服整粒胶囊,可在饭前或饭后服用。
请勿打开、弄破或咀嚼胶囊。
如果未在计划时间服用本品,患者应在当天尽快服用,并在第二天恢复正常用药计划。
请勿额外服用本品以弥补漏服剂量。
推荐的泽布替尼每日口服总剂量为320mg。
给药方案为每次160mg(2 粒80mg胶囊),每日两次,直到发生疾病进展或出现不可耐受的毒性。
与 CYP3A 抑制剂或诱导剂联合给药时的剂量调整
无症状的淋巴细胞增多不应视为不良反应,出现此事件的患者应继续服用本品。
【注意事项】
出血
在接受本品单药治疗的血液系统恶性肿瘤患者中,曾发生严重出血和致死性出血事件。
3.1%的患者发生严重出血事件,其中包括血尿和上消化道出血(各 0.4%)。
3.5%的患者发生3级或更高级别的出血事件,其中包括血尿(0.4%)、硬膜下出血(0.3%)、胃肠出血(0.3%)和胸腔积血(0.3%)。
52.8%的患者发 生任意级别的出血事件,以紫癜/瘀点/青肿和血尿常见(>10%)。
分别有0.6%、 4.6%和1.3%的患者因出血事件降低本品剂量、暂停给药和终止治疗。
出血事件的发生机制尚不清楚。
本品可能会增加接受抗血小板或抗凝治疗患者的出血风险,应监测患者的出 血迹象。
需接受手术的患者,应根据手术类型和出血的风险,进行风险获益评估, 考虑在术前和术后暂停本品 3-7 天。
如发生与治疗有关的 3 级或 3 级以上的出血或任何级别的颅内出血时,应永 久终止本品治疗。
感染
在接受本品单药治疗的血液系统恶性肿瘤患者中有致死性严重感染(包括细 菌、病毒或真菌)和机会性感染的报告。
有 26.3%患者发生 3 级或以上级别的感 染事件,其中最常见的是感染性肺炎(10.1%)。
分别有 1.5%、16.6%和 2.7%的 患者发生导致降低本品剂量、暂停给药和治疗终止的感染事件。
对感染高危患者,应考虑对单纯疱疹病毒、耶氏肺孢子虫肺炎和其他感染进 行预防治疗。
监测和评估患者是否出现发热或其他感染的症状和体征,并给予相 应治疗。
乙肝病毒(HBV)再激活
在本品单药的临床试验中有乙型肝炎病毒再激活(1.2%)报告。
在这些临床试验中,活动性乙型肝炎患者已除外。
本品对于乙型肝炎病毒再激活的影响尚不清楚。
应在使用本品前明确乙型肝炎病毒状态。
若患者目前或既往有乙型肝炎病毒感染,建议在开始本品治疗前咨询肝炎专科医师,并依据当地诊疗常规监测管 理,以防止乙型肝炎复发。
在临床试验中乙型肝炎核心抗体阳性患者须接受预防性抗乙型肝炎病毒治疗。
血细胞减少症
基于实验室检测结果,在接受本品单药治疗的血液系统恶性肿瘤患者中,血细胞减少十分常见,表现为中性粒细胞减少、血小板减少和贫血,并常见有 3 级 或 4 级血细胞减少症的报告。
常见(≥1%)患者因血细胞减少症,包括中性粒细胞减少症(8.2%)、血小 板减少症(2.3%)和贫血(1.2%)中断治疗;分别有 1.3%、0.3%和 0.1%患者因 中性粒细胞减少症、血小板减少症和贫血降低本品剂量;偶见(<1%)患者因血 细胞减少终止治疗。
在治疗期间建议密切监测全血细胞计数,如发生血细胞减少,应根据临床需 求给予对症治疗;必要时暂停用药,待相关血液学不良反应缓解至用药条件后再恢复用药。
第二原发恶性肿瘤
同类产品有发生第二原发恶性肿瘤的报道。
在接受本品单药治疗的血液系统 恶性肿瘤患者中,有12.1%发生第二原发恶性肿瘤,最常见的是皮肤癌 (8.1%) (其中包括基底细胞癌[4.5%]和皮肤鳞状细胞癌[2.8%])。
建议患者做好防晒措施。
心律失常
同类产品的临床试验和上市后观察中均报道过房颤、房扑及室性心动过速。
在接受本品单药治疗的血液系统恶性肿瘤患者中,有 2.2%的患者发生房颤或房扑事件,其中 0.6%的患者为 3 级或以上级别事件;0.6%的患者发生室性期外收 缩或室性心律失常,其中0.1%的患者为 3 级或以上级别事件。
存在心脏风险因 素、患有高血压和急性感染患者的风险可能会增加。
在接受本品治疗期间,应定期监测患者是否发生心律失常,对出现心律不齐症状(如心悸、头晕、昏厥、胸部不适或新发呼吸困难)的患者进行临床评价,根据指征要求患者接受心电图(ECG)检查。
出现心律失常时应及时调整治疗。
肿瘤溶解综合征
使用本品单药治疗时,尤其是在接受治疗的慢性淋巴细胞白血病(CLL)患者中,已有肿瘤溶解综合征个案报告。
治疗前应评估风险(如高肿瘤负荷)并采取适当的预防措施。
密切监测患者并予以适当的治疗。
高血压
在接受本品单药治疗的血液系统恶性肿瘤患者中,有10.1%的患者发生高血 压事件,其中4.0%为3级或者以上级别。
无患者因高血压导致降低本品剂量或终止治疗。
仅有1例(0.1%)患者因高血压暂停给药。
应定期监测接受本品治疗患者的血压,并酌情使用新的降压药或调整原有降压药治疗。

在急性髓细胞白血病治疗领域,一项重要进展有望破解临床精准治疗难题。近日,上海交通大学医学院附属瑞金医院王侃侃教授团队在国际权威期刊发表研究成果,成功开发出基于八...
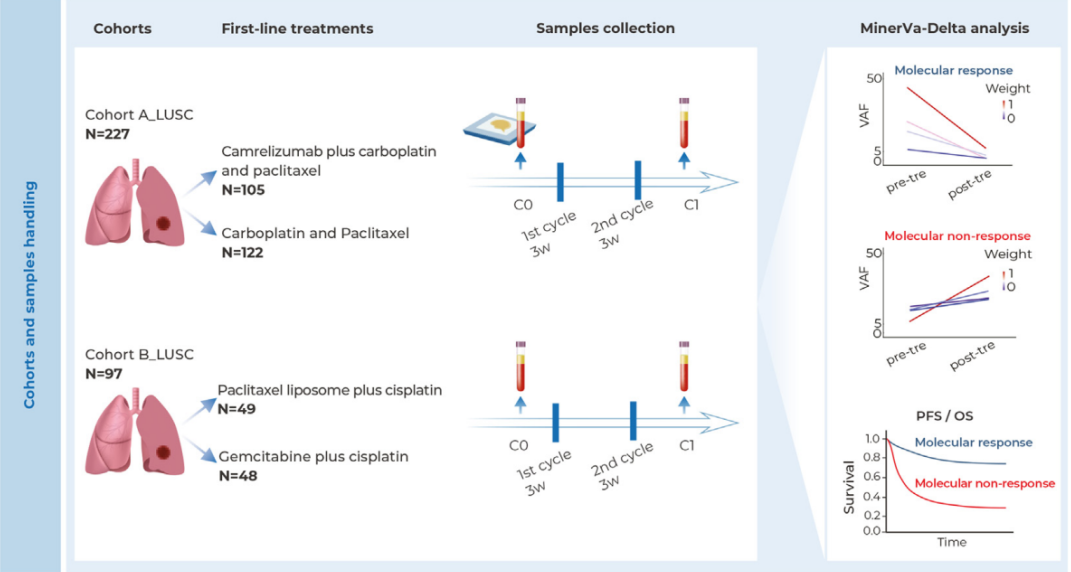
在晚期肺鳞状细胞癌治疗领域,一项名为MinerVa-Delta的创新技术正为疗效评估带来革命性突破。近日发表于《Journal of Thoracic Onco...
在抗癌创新疗法领域,近期接连传来振奋人心的进展。两款分别针对非小细胞肺癌特定突变和晚期皮肤鳞状细胞癌的创新疗法,在监管审批与临床数据层面取得重要突破,为特定患者...
杭州——一位82岁高龄的多发性骨髓瘤患者在浙大二院血液内科成功接受BCMA CAR-T细胞治疗后获得严格完全缓解,原本骨髓中高达68.5%的癌细胞被彻底清除。这...

在近日公布的2025年国家医保目录中,强生公司创新制药旗下三款重磅药物成功入选,覆盖克罗恩病、溃疡性结肠炎及前列腺癌三大疾病领域。同时,其靶向多发性骨髓瘤的创新...
扬子江药业提交的泊马度胺胶囊上市申请正式获得国家药监局批准,视同通过一致性评价。此次获批包括1mg、4mg两个规格,标志着扬子江药业成为国内第三家获批该品种的企...