在急性髓细胞白血病治疗领域,一项重要进展有望破解临床精准治疗难题。近日,上海交通大学医学院附属瑞金医院王侃侃教授团队在国际权威期刊发表研究成果,成功开发出基于八基因的机器学习模型,可精准预测患者对维奈托克联合阿扎胞苷方案的疗效反应,为这一重要治疗方案的个体化应用提供了创新工具。

临床困境:缺乏有效生物标志物制约精准治疗
急性髓细胞白血病作为高度异质性的血液恶性肿瘤,其治疗亟需精准化方案。对于不适合强化化疗的患者,BCL-2抑制剂维奈托克联合阿扎胞苷已成为标准一线选择。然而,临床实践中约30-40% 的患者对该方案初始不敏感或治疗后复发,由于缺乏可靠的预测生物标志物,医生难以在治疗前准确识别获益人群,成为制约精准治疗的关键瓶颈。
研究团队通过分析大规模体外药物筛选数据,发现不同患者对两种药物存在“互补性敏感”模式:部分患者对维奈托克更敏感,而另一些则对阿扎胞苷反应更好。这种差异为联合用药的协同效应提供了科学解释,也凸显了开发预测工具的必要性。
模型创新:八基因机器学习实现精准分层
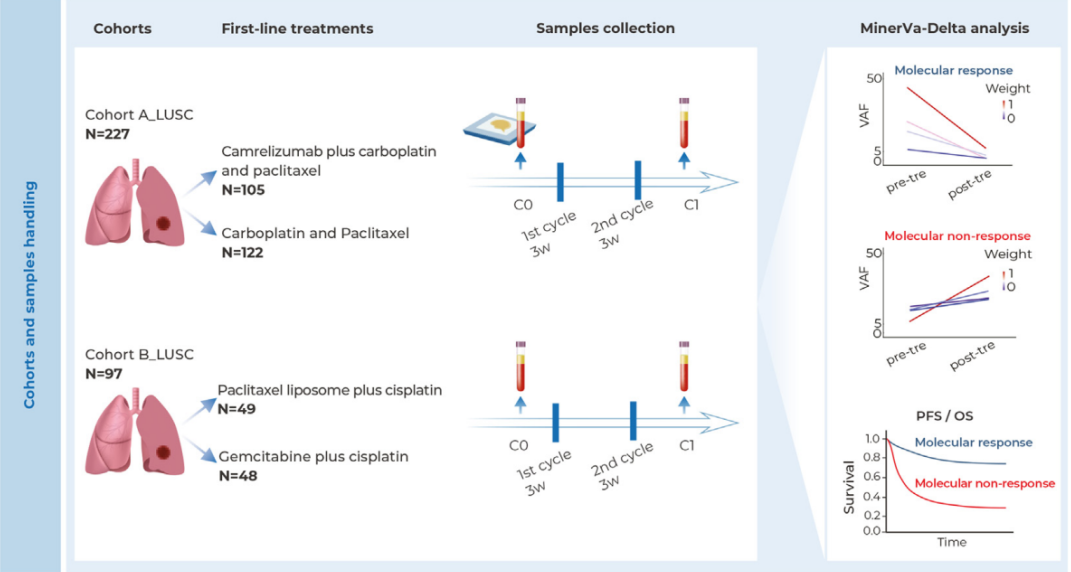
基于多维度数据整合分析,研究团队成功构建了八基因随机森林预测模型。该模型通过整合体外药物筛选、转录组学、功能实验和临床随访数据,在训练队列中展现出稳定的预测性能。更重要的是,在包含498例患者的四个独立验证队列中,RF8模型均表现稳健。
模型输出的连续概率评分与临床缓解率呈显著正相关:评分越高,患者达到完全缓解或伴不完全血细胞恢复的完全缓解的概率越大。通过设定科学阈值,模型可将患者精准分为“高获益概率”和“低获益概率”两大群体,为治疗前决策提供量化依据。
临床价值:超越传统分层实现个体化预后评估
相较于现行的ELN2022、ELN2024等风险分层体系,RF8模型在事件无进展生存和总生存预测方面展现出更优性能。模型评分能够反映不同基因突变的功能性后果:TP53突变患者多集中于低分组,伴随较差的治疗应答;而DNMT3A、IDH2等突变则与高分组及更好疗效相关。
这种连续概率评分体系相比传统分层方法更具临床实用性。对于高分患者,医生可更有信心地选择维奈托克联合方案;而对于低分患者,则可及早考虑替代或联合治疗策略,避免无效治疗带来的时间延误与资源浪费。
转化前景:简洁模型具备临床推广应用潜力
该研究首创的机器学习预测模型具备显著优势:仅需检测8个基因,易于扩展至标准化检测流程;已申请国家发明专利,具备明确的转化潜力;输出结果为连续概率评分,便于临床沟通与个体化决策。
随着该模型的进一步完善与验证,未来有望发展为AML临床常规检测工具,支持治疗方案的精准选择与前瞻性试验设计。这一突破不仅为维奈托克联合方案的优化应用提供了科学依据,也为血液肿瘤精准治疗树立了创新范例,最终助力更多患者从治疗中获得最大生存获益。