处方药 爱尔兰
| 通用名称 | Xiidra、Lifitegrast、立他司特 |
| 药品规格 | 50 mg |
| 生产企业 | Shire US Inc. |
| 功能主治 | 立他司特适用于治疗干眼症 (DED) 的体征和症状 |
注:立他司特Xiidra为处方药物,外包装仅供参考,需在医生指导下使用,用药前请仔细阅读药品说明书,了解用法用量、禁忌症及不良反应。
【药品说明书】
商品名称:Xiidra
英文名称:Lifitegrast
中文名称:立他司特
全部名称:立他司特、Xiidra、Lifitegrast
适应症
Xiidra ®(lifitegrast滴眼液)5%适用于治疗干眼症 (DED) 的体征和症状。
剂型和规格
含 lifitegrast 50 mg/mL(5%) 的滴眼液。
用法用量
使用一次性容器向每只眼睛滴入1滴Xiidra(立他司特),每日两次(间隔约12小时)。每只眼睛使用后立即丢弃一次性容器。
应在 Xiidra(立他司特)给药前摘除隐形眼镜,并可在给药后 15 min 重新戴入。
不良反应
1、视力模糊、结膜充血、眼睛刺激、头痛
2、流泪增加、眼睛分泌物、眼睛不适、眼睛瘙痒、鼻窦炎
3、支气管痉挛、呼吸窘迫、咽部水肿、舌肿胀
4、荨麻疹、过敏性结膜炎、呼吸困难、血管性水肿、过敏性皮炎
5、偶见眼部肿胀和皮疹
特殊人群用药
1、妊娠
尚无妊娠女性使用 Xiidra(立他司特)的可用数据告知任何药物相关风险。
2、哺乳期
尚无关于人乳汁中存在lifitegrast(立他司特)、对母乳喂养婴儿的影响或对乳汁生成影响的数据。然而,lifitegrast(立他司特)眼部给药后的全身暴露量较低 。应考虑母乳喂养对发育和健康的益处,以及母亲对 Xiidra(立他司特)的临床需求和 Xiidra(立他司特)对母乳喂养儿童的任何潜在不良影响。
3、儿童用药
尚未确定在17岁以下儿童患者中的安全性和疗效。
4、老年患者用药
在老年和年轻成人患者之间未观察到安全性或有效性的总体差异。
禁忌症
Xiidra 禁用于已知对 lifitegrast(立他司特)或制剂中任何其他成分过敏的患者。
成分
本品主要成分为lifitegrast。
性状
无菌、澄清、无色至浅棕黄色等渗溶液。
贮存方法
储存于20°C-25°C(68°F-77°F)。将一次性容器储存在原始铝箔袋中。
生产厂家
Shire US Inc.
【适应症】
Xiidra ®(lifitegrast滴眼液)5%适用于治疗干眼症 (DED) 的体征和症状。
【副作用】
1、视力模糊、结膜充血、眼睛刺激、头痛
2、流泪增加、眼睛分泌物、眼睛不适、眼睛瘙痒、鼻窦炎
3、支气管痉挛、呼吸窘迫、咽部水肿、舌肿胀
4、荨麻疹、过敏性结膜炎、呼吸困难、血管性水肿、过敏性皮炎
5、偶见眼部肿胀和皮疹
【用法用量】
使用一次性容器向每只眼睛滴入1滴Xiidra(立他司特),每日两次(间隔约12小时)。每只眼睛使用后立即丢弃一次性容器。
应在 Xiidra(立他司特)给药前摘除隐形眼镜,并可在给药后 15 min 重新戴入。
【注意事项】
特殊人群用药
1、妊娠
尚无妊娠女性使用 Xiidra(立他司特)的可用数据告知任何药物相关风险。
2、哺乳期
尚无关于人乳汁中存在lifitegrast(立他司特)、对母乳喂养婴儿的影响或对乳汁生成影响的数据。然而,lifitegrast(立他司特)眼部给药后的全身暴露量较低 。应考虑母乳喂养对发育和健康的益处,以及母亲对 Xiidra(立他司特)的临床需求和 Xiidra(立他司特)对母乳喂养儿童的任何潜在不良影响。
3、儿童用药
尚未确定在17岁以下儿童患者中的安全性和疗效。
4、老年患者用药
在老年和年轻成人患者之间未观察到安全性或有效性的总体差异。
禁忌症
Xiidra 禁用于已知对 lifitegrast(立他司特)或制剂中任何其他成分过敏的患者。

在急性髓细胞白血病治疗领域,一项重要进展有望破解临床精准治疗难题。近日,上海交通大学医学院附属瑞金医院王侃侃教授团队在国际权威期刊发表研究成果,成功开发出基于八...
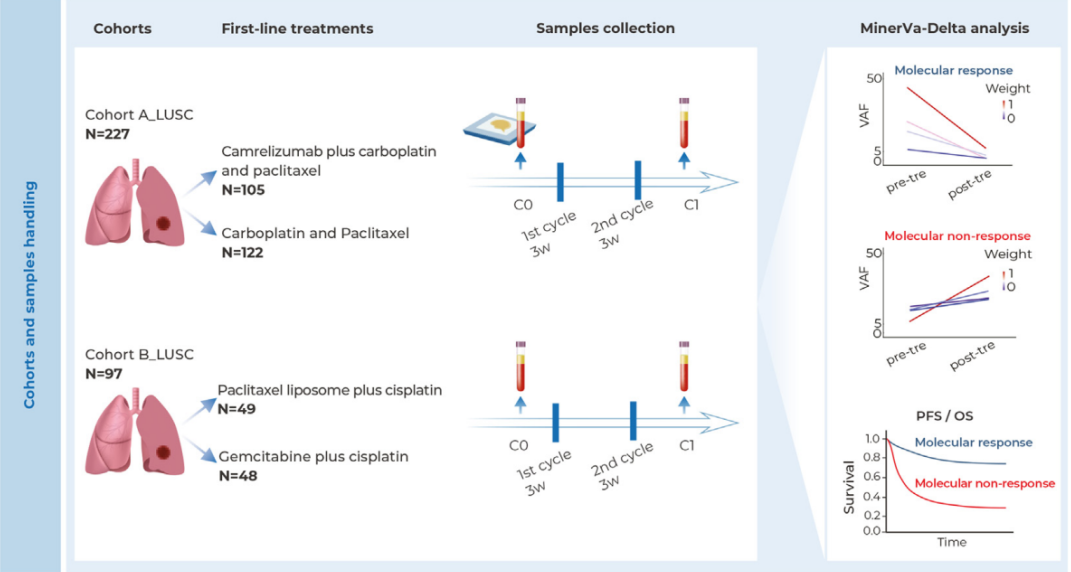
在晚期肺鳞状细胞癌治疗领域,一项名为MinerVa-Delta的创新技术正为疗效评估带来革命性突破。近日发表于《Journal of Thoracic Onco...
在抗癌创新疗法领域,近期接连传来振奋人心的进展。两款分别针对非小细胞肺癌特定突变和晚期皮肤鳞状细胞癌的创新疗法,在监管审批与临床数据层面取得重要突破,为特定患者...
杭州——一位82岁高龄的多发性骨髓瘤患者在浙大二院血液内科成功接受BCMA CAR-T细胞治疗后获得严格完全缓解,原本骨髓中高达68.5%的癌细胞被彻底清除。这...

在近日公布的2025年国家医保目录中,强生公司创新制药旗下三款重磅药物成功入选,覆盖克罗恩病、溃疡性结肠炎及前列腺癌三大疾病领域。同时,其靶向多发性骨髓瘤的创新...
扬子江药业提交的泊马度胺胶囊上市申请正式获得国家药监局批准,视同通过一致性评价。此次获批包括1mg、4mg两个规格,标志着扬子江药业成为国内第三家获批该品种的企...






