在癌症治疗领域,一场从实验室走向临床的技术革命正在悄然兴起。体内CAR工程正以其突破性的技术理念,重新定义免疫治疗的未来格局,有望让原本复杂且昂贵的CAR-T疗法变得像普通输液一样简便可行。
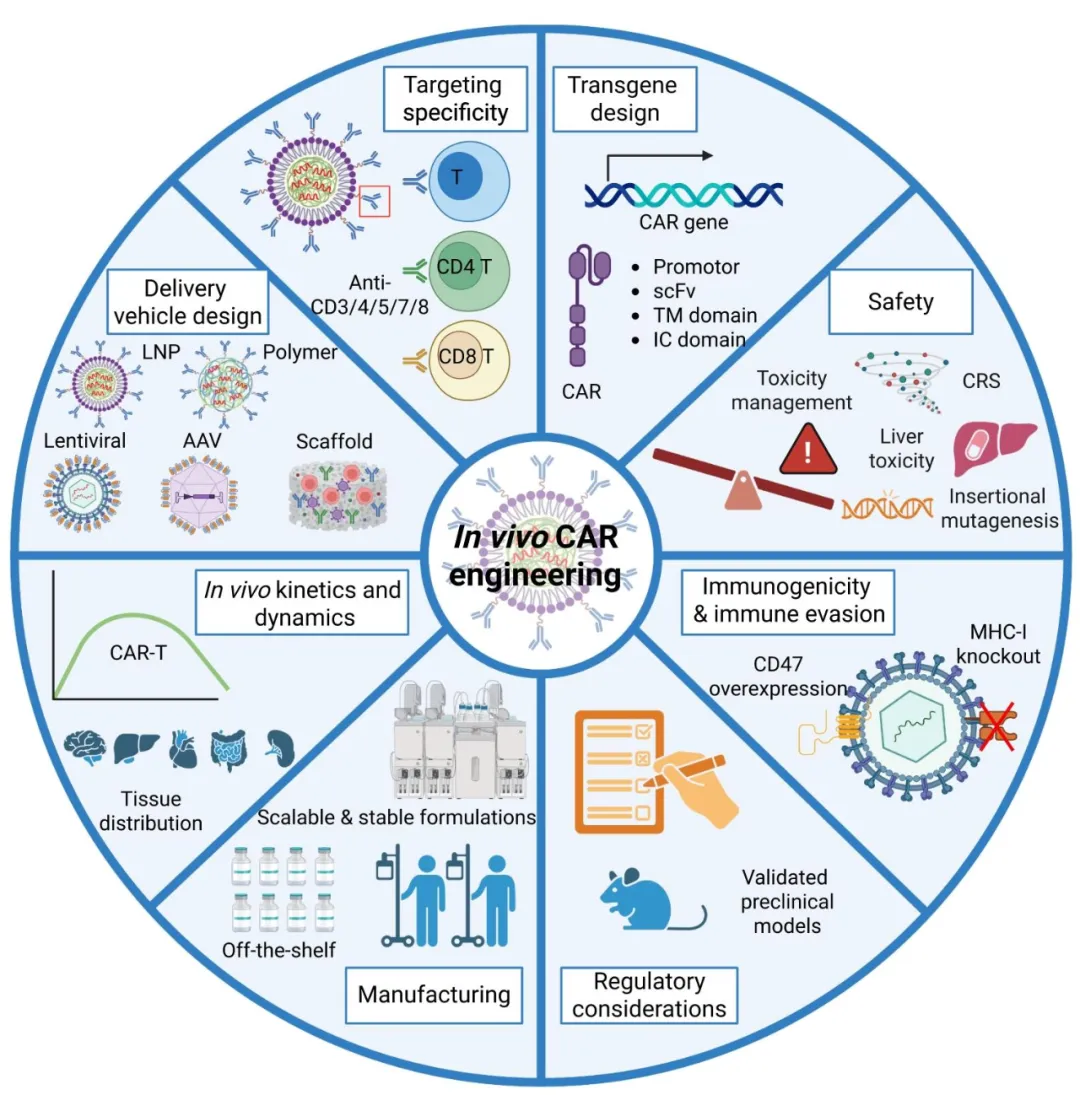
技术突破:告别繁琐制造,实现“体内编程”
传统CAR-T疗法虽疗效显著,但其复杂的制造流程长期制约着广泛应用。从患者体内采集免疫细胞,经过体外基因改造、扩增培养,再回输至患者体内,整个过程不仅耗时数周,成本高昂,还面临严格的冷链运输和供应链挑战。
体内CAR工程的出现颠覆了这一传统模式。这一创新技术通过将CAR转基因直接递送到患者体内的T细胞中,使T细胞在人体内原位“变身”为能够精准识别并杀伤癌细胞的CAR-T细胞。这种“即取即用”的治疗策略,彻底避免了繁琐的细胞单采、体外制造和淋巴耗竭预处理等步骤,显著降低了治疗门槛。
为实现这一目标,科学家开发了多种递送工具,包括脂质纳米颗粒包封的核酸、慢病毒载体、腺相关病毒以及生物指导性可植入支架等新型平台,力求在实现高效靶向递送的同时,最大限度减少脱靶效应。
临床验证:多重平台展示治疗潜力
在临床探索中,不同递送平台已展现出令人鼓舞的潜力。在一项针对复发难治性多发性骨髓瘤的首次人体临床试验中,研究人员使用经过多重工程化改造的慢病毒载体,将BCMA靶向CAR基因直接递送至患者T细胞。四名参与试验的患者中,两人实现严格完全缓解,另外两人达到部分缓解,初步证实了该疗法的有效性。
与此同时,脂质纳米颗粒平台在临床前研究中展示了更广泛的应用前景。通过装载CAR mRNA并靶向CD8⁺ T细胞,该平台不仅在癌症模型中显示出抗肿瘤活性,在自身免疫性疾病模型中也实现了有效的B细胞耗竭。特别值得关注的是,在非人灵长类动物实验中,两剂方案即可达到持久的治疗效果。
挑战与前景:安全性与可及性的双重提升
尽管体内CAR工程展现出巨大潜力,但其临床转化仍面临安全性挑战。现有临床试验中,细胞因子释放综合征等不良事件仍需密切关注。为此,研究人员正着力开发更精准的靶向递送系统、引入药物诱导的“自杀开关”机制,并探索非整合型载体等策略以增强治疗可控性。
目前,该技术研发主要聚焦于B细胞恶性肿瘤和自身免疫性疾病领域,未来有望借助器官偏好性递送进一步拓展至实体瘤治疗。不同递送平台各有优势:慢病毒载体可实现CAR的持久表达,而脂质纳米颗粒平台则具备更好的可扩展性和剂量调节能力。
随着越来越多的生物科技公司投入研发,体内CAR工程正从早期探索走向成熟应用。这一技术不仅有望大幅降低治疗成本,还将显著提升CAR-T疗法的可及性,使其从少数患者的“定制奢侈品”转变为更多患者的“普惠选择”,最终可能重塑整个免疫治疗领域的格局。














