
处方药 老挝
| 通用名称 | 来那卡帕韦、来那帕韦纳、Lenacapavir、ALI-LENA |
| 药品规格 | 300mg*5片;463.5mg/1.5mL/瓶*2瓶 |
| 生产企业 | 老挝联合制药 |
| 功能主治 | 该药物主要用于与其他抗反转录病毒药物联合使用,治疗当前治疗方案无法实现病毒学抑制的多重耐药1型人类免疫缺陷病毒(HIV-1)感染的成人患者。 |
注:来那帕韦Lenacapavir为处方药物,外包装仅供参考,需在医生指导下使用,用药前请仔细阅读药品说明书,了解用法用量、禁忌症及不良反应。
【药品说明书】
来那帕韦(Lenacapavir)Sunlenca是一种新型抗病毒药物,主要用于治疗HIV感染。它属于衣壳抑制剂,通过干扰病毒衣壳结构抑制病毒复制,适用于多重耐药HIV患者的联合治疗。该药为处方药,需严格尊医嘱使用。
【生产厂家】美国吉利德公司 GileadSciences,Inc.
【商标】Sunlenca
【通用名】Lenacapavir
【中文名】来那卡帕韦、利那卡帕韦
【规格】
片剂为米色胶囊状薄膜包衣片:规格一:4片/泡罩包装;规格二:5片/泡罩包装。
注射剂试剂盒包含:一、2个单剂量小瓶,每瓶足以抽出463.5mg/1.5mL(309mg/mL) Lenacapavir;二、2个药瓶接入装置、2个一次性注射器和2个用于皮下注射的注射安全针(22号,½英寸)。
【存储】
储存在20°C–25°C(68°F–77°F)温度下,允许波动范围为15°C–30°C(59°F–86°F)。片剂仅在原装泡罩包装中分装和储存。将小瓶保存在原纸盒中,直至准备注射前,以防止光线照射。将溶液抽入注射器后,应尽快进行注射。丢弃溶液中任何未使用的部分。
【来那帕韦(Lenacapavir)Sunlenca适应症和用法】
来那帕韦(Lenacapavir)Sunlenca,一种人类免疫缺陷病毒1型(HIV-1)衣壳抑制剂,与其他抗逆转录病毒药物联合使用,用于治疗因耐药、不耐受或安全性考虑而导致当前抗逆转录病毒治疗失败且具有大量治疗经验的多药耐药HIV-1感染成人的HIV-1感染。
【来那帕韦(Lenacapavir)Sunlenca剂量和给药】
推荐剂量——从两种选择中的一种开始,然后每6个月维持给药一次。服用片剂时可不考虑食物。
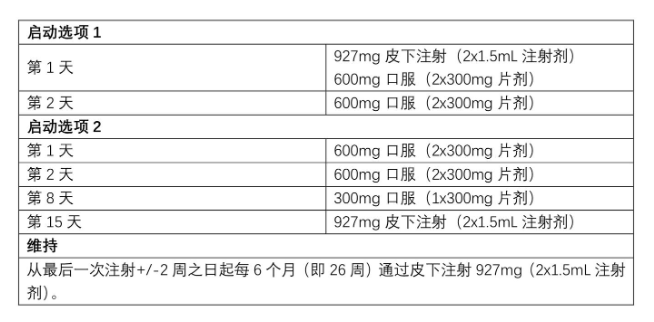
错过剂量:如果自上次注射后超过28周且临床上适合继续使用Sunlenca,则使用选项1或选项2从第1天重新开始。
完整剂量需要两次1.5 mL 皮下注射。
【来那帕韦(Lenacapavir)Sunlenca剂型和规格】
片剂:300mg。
注射剂:463.5mg/1.5mL(309mg/mL)在单剂量小瓶中。
【来那帕韦(Lenacapavir)Sunlenca禁忌症】
强CYP3A诱导剂禁止来那帕韦(Lenacapavir)Sunlenca联合给药。
【来那帕韦(Lenacapavir)Sunlenca警告和注意事项】
免疫重建综合征:可能需要进一步评估和治疗。
lenacapavir的残留浓度可能会在体循环中保留长达12个月或更长时间。就给药方案向患者提供建议;不依从性可能导致病毒学应答丧失和耐药性的进展。
在来那帕韦(Lenacapavir)Sunlenca最后一次皮下给药后9个月内开始,可能会增加对主要由CYP3A代谢的药物的暴露和不良反应的风险。
如果停药,尽可能在最后一次注射来那帕韦(Lenacapavir)Sunlenca后28周内启动替代的、完全抑制性抗逆转录病毒治疗方案。如果发生病毒学失败,请尽可能改用替代方案。
可能会发生注射部位反应,结节和硬结可能会持续存在。
【来那帕韦(Lenacapavir)Sunlenca不良反应】
最常见的不良反应(发生率大于或等于3%,所有级别)是恶心和注射部位反应。
【来那帕韦(Lenacapavir)Sunlenca药物相互作用】
在治疗前和治疗期间,请查阅完整处方信息,了解重要的药物相互作用。
【来那帕韦(Lenacapavir)Sunlenca在特定人群中使用】
哺乳:应指导感染HIV的患者不要母乳喂养,因为有可能传播HIV。
一、作用机制
靶向衣壳蛋白: 通过结合HIV衣壳蛋白,破坏其正常组装和分解过程,阻断病毒生命周期。长效作用:皮下注射剂型可实现半年一次的长效治疗,提高用药依从性。
二、适应症
用于成人HIV-1感染,尤其对现有抗逆转录药物耐药或治疗失败的患者。
需与其他抗病毒药物联用,避免单独使用导致耐药性。
三、用法与用量
注射剂: 通常每6个月皮下注射一次,具体剂量由医生根据患者情况调整。
片剂 : 每次600mg,使用时间遵循医生指导安排。
四、常见副作用
1.注射部位反应(疼痛、红肿)。
2.头痛、腹泻、恶心等胃肠道症状。
五、注意事项
1.耐药风险:单独使用易引发耐药,必须联合其他抗病毒药物。
2.禁忌人群:对成分过敏者、严重肝肾功能不全者慎用;妊娠期和哺乳期需评估风险。
3.药物相互作用:可能与部分抗病毒药、肝酶诱导剂存在相互作用,需告知医生用药史。
【适应症】
来那帕韦(Lenacapavir)Sunlenca,一种人类免疫缺陷病毒1型(HIV-1)衣壳抑制剂,与其他抗逆转录病毒药物联合使用,用于治疗因耐药、不耐受或安全性考虑而导致当前抗逆转录病毒治疗失败且具有大量治疗经验的多药耐药HIV-1感染成人的HIV-1感染。
【副作用】
最常见的不良反应(发生率大于或等于3%,所有级别)是恶心和注射部位反应。
【用法用量】
推荐剂量——从两种选择中的一种开始,然后每6个月维持给药一次。服用片剂时可不考虑食物。
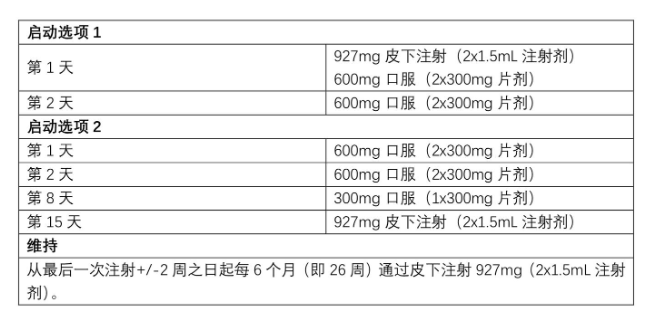
错过剂量:如果自上次注射后超过28周且临床上适合继续使用Sunlenca,则使用选项1或选项2从第1天重新开始。
完整剂量需要两次1.5 mL 皮下注射。
【注意事项】
免疫重建综合征:可能需要进一步评估和治疗。
lenacapavir的残留浓度可能会在体循环中保留长达12个月或更长时间。就给药方案向患者提供建议;不依从性可能导致病毒学应答丧失和耐药性的进展。
在来那帕韦(Lenacapavir)Sunlenca最后一次皮下给药后9个月内开始,可能会增加对主要由CYP3A代谢的药物的暴露和不良反应的风险。
如果停药,尽可能在最后一次注射来那帕韦(Lenacapavir)Sunlenca后28周内启动替代的、完全抑制性抗逆转录病毒治疗方案。如果发生病毒学失败,请尽可能改用替代方案。
可能会发生注射部位反应,结节和硬结可能会持续存在。

在急性髓细胞白血病治疗领域,一项重要进展有望破解临床精准治疗难题。近日,上海交通大学医学院附属瑞金医院王侃侃教授团队在国际权威期刊发表研究成果,成功开发出基于八...
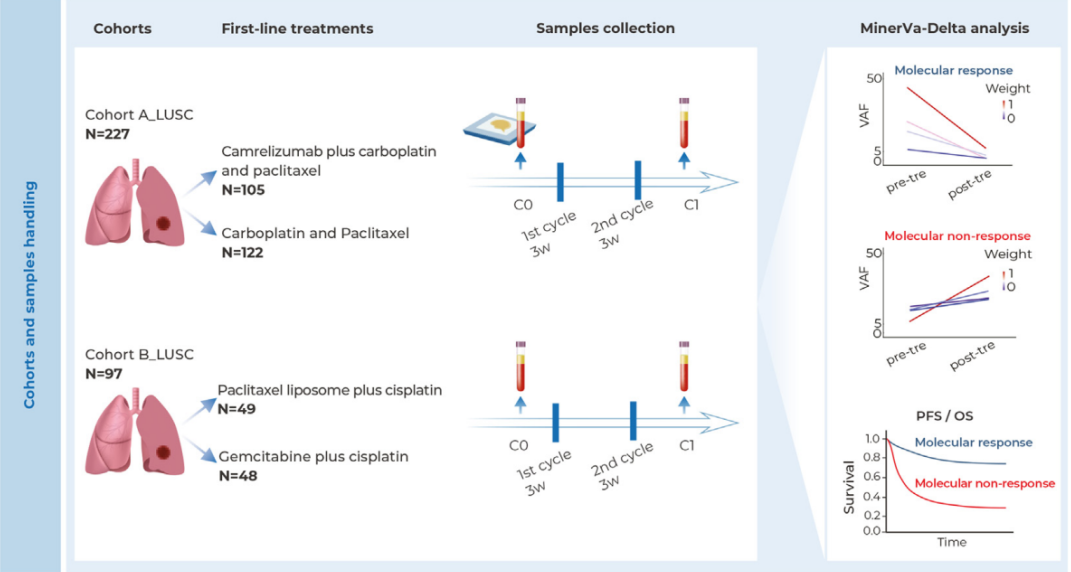
在晚期肺鳞状细胞癌治疗领域,一项名为MinerVa-Delta的创新技术正为疗效评估带来革命性突破。近日发表于《Journal of Thoracic Onco...
在抗癌创新疗法领域,近期接连传来振奋人心的进展。两款分别针对非小细胞肺癌特定突变和晚期皮肤鳞状细胞癌的创新疗法,在监管审批与临床数据层面取得重要突破,为特定患者...
杭州——一位82岁高龄的多发性骨髓瘤患者在浙大二院血液内科成功接受BCMA CAR-T细胞治疗后获得严格完全缓解,原本骨髓中高达68.5%的癌细胞被彻底清除。这...

在近日公布的2025年国家医保目录中,强生公司创新制药旗下三款重磅药物成功入选,覆盖克罗恩病、溃疡性结肠炎及前列腺癌三大疾病领域。同时,其靶向多发性骨髓瘤的创新...
扬子江药业提交的泊马度胺胶囊上市申请正式获得国家药监局批准,视同通过一致性评价。此次获批包括1mg、4mg两个规格,标志着扬子江药业成为国内第三家获批该品种的企...






