
处方药 老挝
| 通用名称 | 艾曲波帕、ALIEITROBPA |
| 药品规格 | 25mg 28片/瓶 |
| 生产企业 | 老挝联合制药 |
| 功能主治 | 本品适用于既往对糖皮质激素、免疫球蛋白或脾切除术反应不佳的1岁以上的儿童及成人患有持续性或慢性免疫性血小板减少症(ITP)的患者。本品应仅用于血小板减少程度和临床状况会增加出血风险的ITP患者。 本品适用丙型肝炎患者血小板减少症的治疗。 与标准免疫抑制疗法联合应用于2岁及以上严重再生障碍性贫血的成人和儿童患者的一线治疗。 用于治疗对免疫抑制治疗反应不足的严重再生障碍性贫血患者。 |
注:艾曲波帕乙醇胺片为处方药物,外包装仅供参考,需在医生指导下使用,用药前请仔细阅读药品说明书,了解用法用量、禁忌症及不良反应。
【药品说明书】
【通用名称】艾曲波帕乙醇胺片
【品牌名称】ALIEITROBPA
【主要成分】
艾曲波帕 25mg。
【适应症】
本品适用于既往对糖皮质激素、免疫球蛋白或脾切除术反应不佳的1岁以上的儿童及成人患有持续性或慢性免疫性血小板减少症(ITP)的患者。本品应仅用于血小板减少程度和临床状况会增加出血风险的ITP患者。
本品适用丙型肝炎患者血小板减少症的治疗。
与标准免疫抑制疗法联合应用于2岁及以上严重再生障碍性贫血的成人和儿童患者的一线治疗。
用于治疗对免疫抑制治疗反应不足的严重再生障碍性贫血患者。
使用限制
本品不适用于骨髓增生异常综合征(MDS)患者的治疗。
【用法用量】
在不用餐或低钙餐(≤50 mg)的情况下服用本品。
持续性或慢性ITP:对于大多数6岁及以上的成人和儿童患者,起始剂量为50mg,每日一次;对于1 - 5岁的儿童患者,起始剂量为25mg,每日一次。肝损害患者和一些东亚/东南亚血统的患者需要减少剂量。调整以维持血小板计数大于或等于50×109/L。每天不要超过75mg。
慢性丙型肝炎相关血小板减少症:起始剂量为25mg,每日一次。每日剂量不要超过100mg。
重度再生障碍性贫血一线治疗:每日1次,剂量为2.5mg/kg(2 - 5岁儿童患者),75 mg(6 - 11岁儿童患者),或150 mg(12岁及以上患者),同时进行标准免疫抑制治疗。
难治性重度再生障碍性贫血:起始剂量为50mg,每日一次。降低肝功能损害患者或东亚/东南亚血统患者的初始剂量。
【禁忌】
无。
【注意事项】
1.肝毒性:治疗前和治疗中监测肝功能。
2.急性髓系白血病骨髓增生异常综合征的死亡和进展风险增加本药给药期间,应定期进行血液检查和肝功能检查,并调整本药剂量。
3.血栓/血栓栓塞并发症:定期监测血小板计数。
【不良反应】贫血、恶心、发热、丙氨酸转氨酶升高、咳嗽、疲劳、头痛和腹泻。
【性状】橙色圆形片剂。
【有效期】36个月。
【包装】28片/瓶。
【贮存】
室温保存,不超过30℃。
请置于儿童接触不到的地方。
【生产企业】
老挝联合制药集团厂。
【适应症】
本品适用于既往对糖皮质激素、免疫球蛋白或脾切除术反应不佳的1岁以上的儿童及成人患有持续性或慢性免疫性血小板减少症(ITP)的患者。本品应仅用于血小板减少程度和临床状况会增加出血风险的ITP患者。
本品适用丙型肝炎患者血小板减少症的治疗。
与标准免疫抑制疗法联合应用于2岁及以上严重再生障碍性贫血的成人和儿童患者的一线治疗。
用于治疗对免疫抑制治疗反应不足的严重再生障碍性贫血患者。
【副作用】
贫血、恶心、发热、丙氨酸转氨酶升高、咳嗽、疲劳、头痛和腹泻。
【用法用量】
在不用餐或低钙餐(≤50 mg)的情况下服用本品。
持续性或慢性ITP:对于大多数6岁及以上的成人和儿童患者,起始剂量为50mg,每日一次;对于1 - 5岁的儿童患者,起始剂量为25mg,每日一次。肝损害患者和一些东亚/东南亚血统的患者需要减少剂量。调整以维持血小板计数大于或等于50×109/L。每天不要超过75mg。
慢性丙型肝炎相关血小板减少症:起始剂量为25mg,每日一次。每日剂量不要超过100mg。
重度再生障碍性贫血一线治疗:每日1次,剂量为2.5mg/kg(2 - 5岁儿童患者),75 mg(6 - 11岁儿童患者),或150 mg(12岁及以上患者),同时进行标准免疫抑制治疗。
难治性重度再生障碍性贫血:起始剂量为50mg,每日一次。降低肝功能损害患者或东亚/东南亚血统患者的初始剂量。
【注意事项】
1.肝毒性:治疗前和治疗中监测肝功能。
2.急性髓系白血病骨髓增生异常综合征的死亡和进展风险增加本药给药期间,应定期进行血液检查和肝功能检查,并调整本药剂量。
3.血栓/血栓栓塞并发症:定期监测血小板计数。

在急性髓细胞白血病治疗领域,一项重要进展有望破解临床精准治疗难题。近日,上海交通大学医学院附属瑞金医院王侃侃教授团队在国际权威期刊发表研究成果,成功开发出基于八...
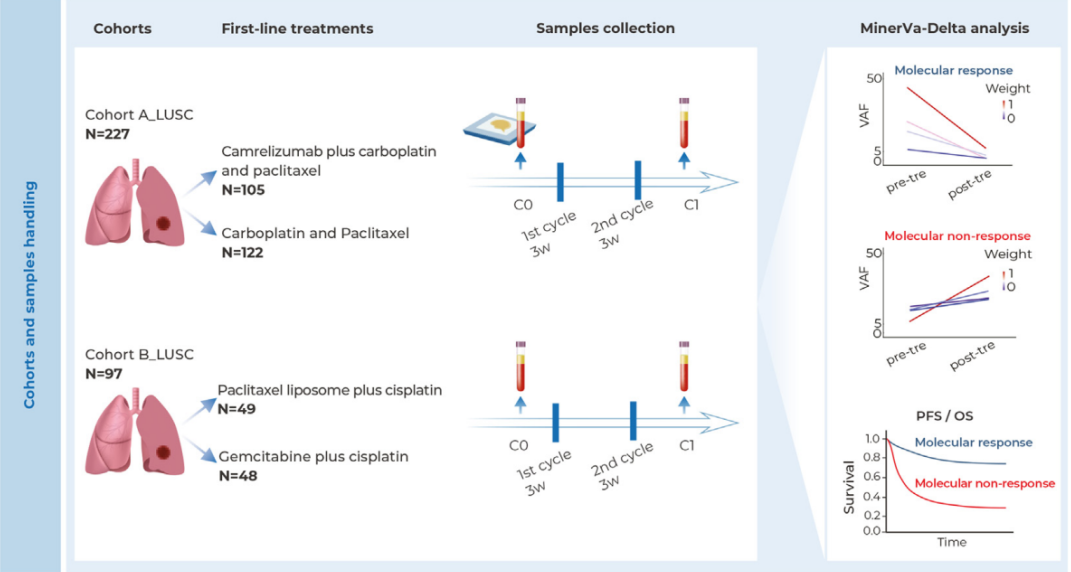
在晚期肺鳞状细胞癌治疗领域,一项名为MinerVa-Delta的创新技术正为疗效评估带来革命性突破。近日发表于《Journal of Thoracic Onco...
在抗癌创新疗法领域,近期接连传来振奋人心的进展。两款分别针对非小细胞肺癌特定突变和晚期皮肤鳞状细胞癌的创新疗法,在监管审批与临床数据层面取得重要突破,为特定患者...
杭州——一位82岁高龄的多发性骨髓瘤患者在浙大二院血液内科成功接受BCMA CAR-T细胞治疗后获得严格完全缓解,原本骨髓中高达68.5%的癌细胞被彻底清除。这...

在近日公布的2025年国家医保目录中,强生公司创新制药旗下三款重磅药物成功入选,覆盖克罗恩病、溃疡性结肠炎及前列腺癌三大疾病领域。同时,其靶向多发性骨髓瘤的创新...
扬子江药业提交的泊马度胺胶囊上市申请正式获得国家药监局批准,视同通过一致性评价。此次获批包括1mg、4mg两个规格,标志着扬子江药业成为国内第三家获批该品种的企...






