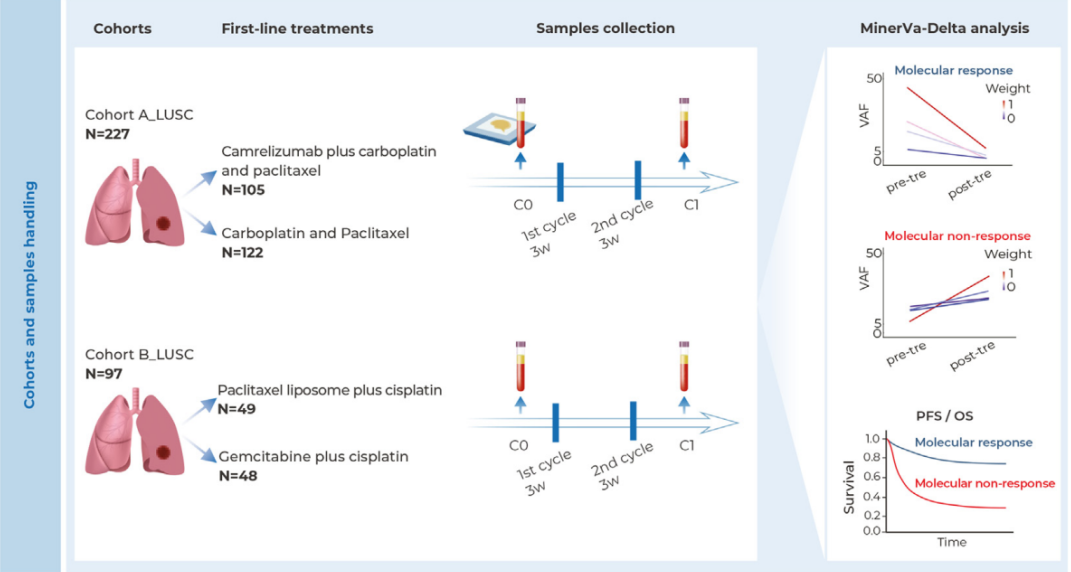
2025年11月21日,药品审评领域迎来罕见严审周。11月17日单日下发77张通知件的异常情况引发行业关注,其中8款首仿药的集体“折戟”尤为引人注目,包括多款市场期待的重磅品种,凸显出当前药品审评标准的日趋严格。
首仿药遭遇“黑色星期一”,多款重磅品种被拒
此周药品审评结果令人意外,仅11月17日一天就有8款首仿药收到通知件。被拒名单中包括济川药业的普伦思特干糖浆剂、奥锐特的雌二醇片/雌二醇地屈孕酮片复合包装、哈尔滨三联的马来酸阿塞那平舌下片等市场关注度较高的品种。
此外,重庆药友的诺西那生钠注射液、宁波美诺华的二甲双胍恩格列净片(Ⅳ)、齐鲁制药的注射用阿立哌唑、常州阳光的瑞舒伐他汀依折麦布片(Ⅱ)以及上海凯宝的依达拉奉右莰醇注射用浓溶液也未能通过审评。除首仿药外,蔗糖铁注射液、噻托溴铵吸入粉雾剂、氟比洛芬凝胶贴膏等多款仿制药也未能通过审评,使得本周仿制药过评数量寥寥。
创新药审评现分化,血友病治疗迎新突破
与仿制药的“惨淡”形成对比的是,创新药领域仍有亮点。辉瑞的血友病用药马塔西单抗注射液本周获批上市,该药采用血友病再平衡疗法,成为全球首个B型血友病每周一次皮下注射药物,同时也是首个适用于A/B型血友病的固定剂量方案,为血友病患者提供了更便捷的治疗选择。
然而,创新药审评同样出现分化态势。成都蓉生的注射用重组人凝血因子Ⅶa本周被下发通知件,据公司官方公告称系自行撤回。目前该品种国内仅有诺和诺德和正大天晴的两款同类药物获批。此外,礼来的替尔泊肽一项适应症上市申请也被发了通知件,具体适应症内容尚未明确。
审评标准趋严,行业面临质量升级挑战
单日下发77张通知件的异常情况,在近年来药品审评中实属罕见。这一现象反映出药品审评标准正在全面提升,对药品质量、疗效和安全性的要求日益严格。
业内专家分析认为,此次大规模的通知件发放,可能与近期药品审评中心加强质量管控、提升审评标准有关。从被拒的药品名单看,涉及多个治疗领域的重要品种,这表明无论是传统药物还是新型制剂,都需要在质量标准和临床数据方面满足更高要求。
这一趋势虽然短期内给部分企业带来压力,但长远看有利于促进医药行业高质量发展,推动企业从“仿制”向“创仿结合”转型,最终受益的将是广大患者。