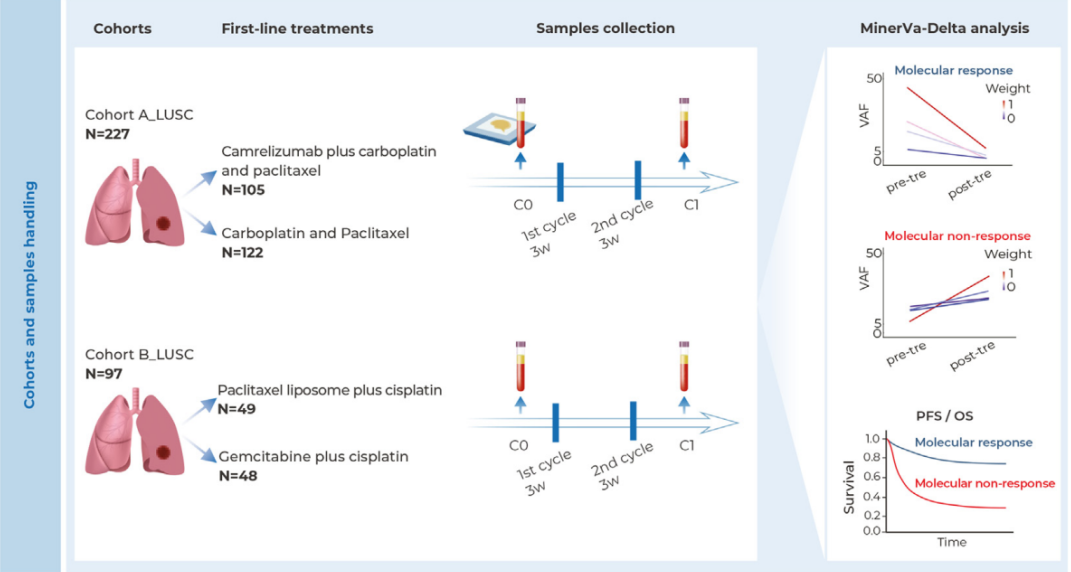
2025年10月24日,复旦大学与上海交通大学联合团队在《Cell》发表重大研究成果,首次揭示癌细胞通过激活“跨器官神经免疫回路”逃避免疫监视的全新机制。这一发现不仅为理解肿瘤免疫逃逸提供了全新视角,更为提高免疫治疗效果开辟了新的途径。
突破性发现:癌细胞构建跨器官逃逸网络
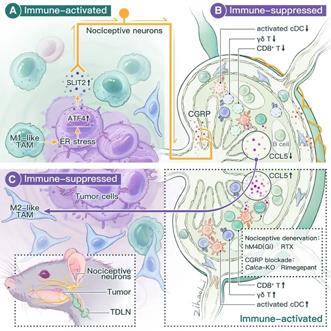
研究团队通过单细胞转录组、空间转录组、蛋白质组等多组学技术,发现处于免疫压力下的癌细胞通过激活ATF4依赖性途径分泌SLIT2蛋白。这种蛋白能够激活支配肿瘤的伤害感受神经元,加剧癌症疼痛,并进一步刺激肿瘤引流淋巴结(TDLN)的神经支配。
被激活的伤害感受神经元增加降钙素基因相关肽(CGRP)的分泌,将肿瘤引流淋巴结重塑为免疫抑制状态。这种免疫抑制导致CCL5分泌减少,进而促进肿瘤相关巨噬细胞向M2样表型极化,最终加速肿瘤生长并降低免疫检查点阻断疗法的疗效。
临床证据:神经密度与免疫抑制直接相关
在对69例头颈部鳞状细胞癌患者的临床分析中,研究团队发现肿瘤内伤害感受神经元密度与患者术前疼痛程度呈正相关。伤害感受神经元丰富区域M2型肿瘤相关巨噬细胞的积累显著增加,呈现明显的免疫抑制特征。
血浆蛋白质组学分析显示,伤害感受神经元丰富的患者组中,与神经系统发育和先天免疫反应相关的蛋白质富集,而免疫效应反应相关的蛋白质则显著减少。CyTOF分析进一步证实,这些患者外周血中CD8+ T细胞比例下降,单核细胞比例增加,呈现系统性的免疫抑制状态。
治疗突破:靶向神经回路提升免疫疗效
研究团队通过动物实验验证了干预这一通路的效果。使用CGRP受体拮抗剂(如临床偏头痛药物利美吉泮)、化学去神经或化学遗传学抑制肿瘤引流淋巴结支配神经元等方式,均能有效恢复免疫活性、减轻癌痛、提升免疫检查点阻断疗法的抗肿瘤效果。
值得注意的是,在头颈部鳞状细胞癌患者中,肿瘤内伤害性神经元密度高的患者表现为术前疼痛重、外周血CD8+ T细胞减少、单核细胞增多,且血浆SLIT2水平升高、CCL5水平降低,这与动物实验发现高度一致。
该研究首次系统揭示了癌细胞利用“跨器官神经免疫回路”实现免疫逃逸的全新机制,突破了传统上仅关注肿瘤微环境的局限,将肿瘤免疫研究拓展至全身系统层面。这一发现不仅深化了对肿瘤免疫逃逸机制的理解,更为开发联合神经调节的肿瘤免疫治疗新策略提供了重要理论基础。