葛兰素史克宣布其创新抗体偶联药物Blenrep获得英国药品和保健品监管局批准,可与泊马度胺+地塞米松联合用于至少接受过一线治疗的成人多发性骨髓瘤患者。这是该药物在全球范围内的首次获批,标志着多发性骨髓瘤治疗迎来重要突破。

疗效显著:无进展生存期提升近三倍
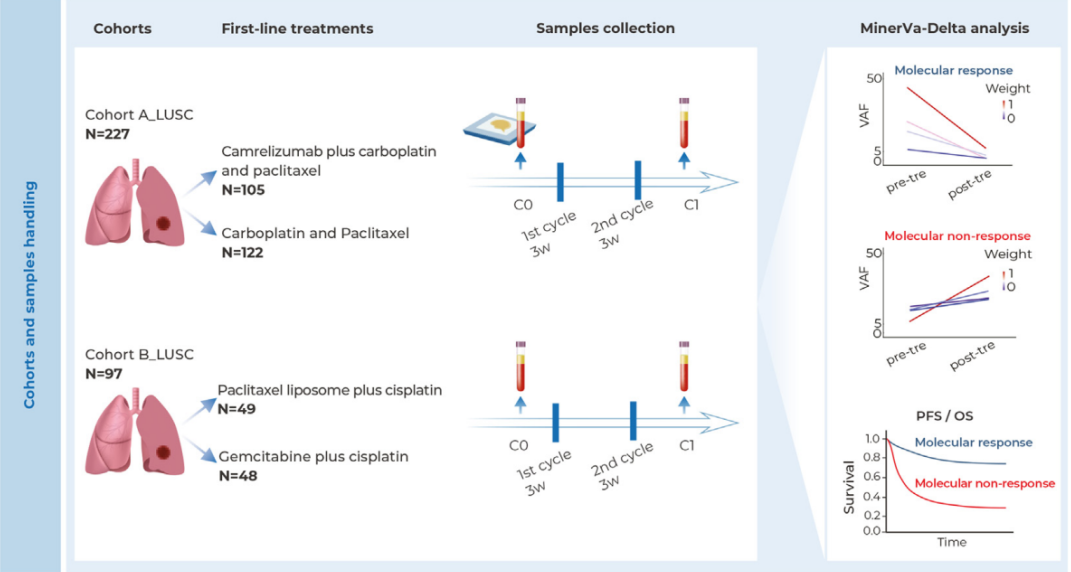
在关键性III期DREAMM-7试验中,Blenrep联合疗法展现出卓越疗效。与达雷妥尤单抗对照组相比,Blenrep组中位无进展生存期达到36.6个月,显著优于对照组的13.4个月,提升幅度接近三倍。更令人鼓舞的是,总生存期分析显示死亡风险降低42%,三年总生存率分别为74%和60%。
在DREAMM-8试验中,经过中位21.8个月的随访,Blenrep组中位无进展生存期尚未达到,而硼替佐米组为12.7个月。这些数据充分证明了该联合方案在改善患者预后方面的显著优势。
安全性可控:眼部不良反应可有效管理
Blenrep联合疗法的安全性和耐受性特征与各单药的已知特性基本一致。眼部不良反应作为Blenrep的已知副作用,通常可缓解,通过延长给药间隔和剂量调整可有效管理。两项试验中因眼毒性导致的停药率均控制在9%以下,显示出良好的临床可管理性。
在DREAMM-7试验中,最常见的非眼部不良事件为血小板减少和腹泻;DREAMM-8中主要为中性粒细胞减少、血小板减少和COVID-19感染。整体安全性特征与复发难治性多发性骨髓瘤患者群体的预期相符。
治疗价值:填补复发患者临床需求
多发性骨髓瘤作为血液系统常见恶性肿瘤,多数患者面临疾病复发的挑战。英国患者确诊后五年生存率仅为55%,凸显了该领域存在的巨大未满足临床需求。Blenrep是唯一靶向B细胞成熟抗原的抗体偶联药物,为复发期患者提供了差异化的治疗选择。
该联合方案的另一个重要优势是可在任何肿瘤治疗场景中适用于各类患者,且无需复杂给药前准备或住院治疗,大大提升了治疗的可及性和便利性。目前,该药物在美国的审评仍在进行中,PDUFA日期定为2025年7月23日。
Blenrep在英国的成功获批,为多发性骨髓瘤患者提供了新的治疗选择。随着该药物在全球更多地区的推广应用,有望为更多复发难治患者带来生存获益,重塑多发性骨髓瘤的治疗格局。