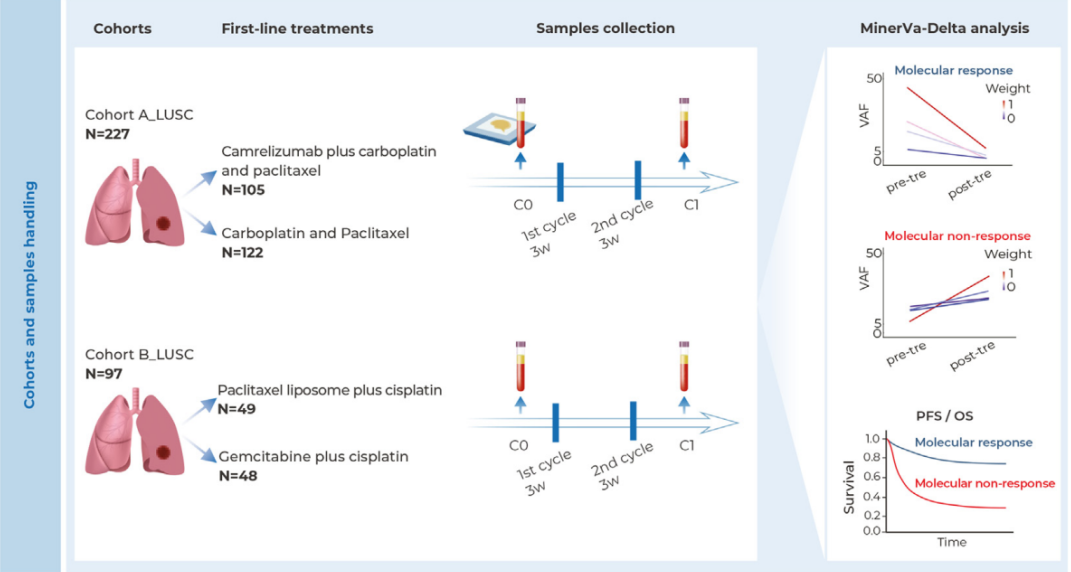
2025年12月3日,美国食品药品监督管理局(FDA)批准了Avance(无细胞神经同种异体移植物-arwx)的手术植入。该产品是一种周围神经支架,可用于治疗成人与儿童(一个月及以上)患者的感觉神经不连续性(神经通路中断,间隙≤25毫米)。在加速批准途径下,其适应症还扩展至更大的感觉神经间隙(>25毫米)以及运动与混合神经不连续性。

突破现有治疗局限
与目前常需从患者自身另取健康神经组织(造成第二手术部位)的自体移植等方法不同,Avance利用经过特殊处理的捐赠者神经组织制成,在去除细胞的同时保留了有助于再生的天然结构。这消除了患者为修复神经而接受额外取神经手术的需要。
基于加速批准途径
FDA通过加速批准途径,基于可合理预测临床获益的替代终点,将Avance的适应症扩大至更广泛的神经损伤类型。此批准依赖于申请人后续提交验证性临床试验结果的要求。FDA官员强调,此举是为解决周围神经损伤患者长期未满足的医疗需求。
疗效与安全性数据
在一项关键疗效研究中,Avance在促进感觉功能恢复方面,统计学上不劣于用于对比的胶原蛋白神经套。常见不良反应包括手术疼痛及感觉过敏(对触、温、痛觉的敏感性增加)。虽由人体组织制成,但尚无病毒性疾病传播病例报告,使用中需监测手术并发症与潜在感染风险。
此次获批的产品Avance由Axogen公司生产。