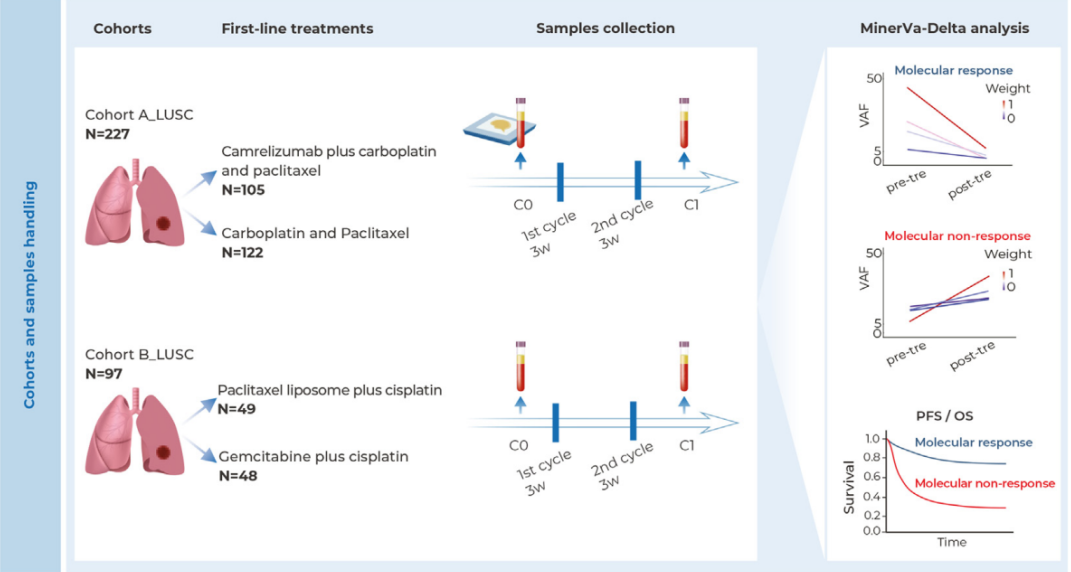
近日,罗氏在年度“制药日”活动上宣布,其FcRH5/CD3双抗cevostamab将于2026年正式启动名为“Cevolution”的III期临床试验。该研究将探索cevostamab联合泊马度胺和地塞米松在二线及以上多发性骨髓瘤治疗中的疗效,此前公布的I期数据显示该联合方案总体缓解率最高达88%。
疗效卓越:联合方案展现突破性潜力
在本次活动中,罗氏重点公布了cevostamab联合泊马度胺和地塞米松的I期Camma 1试验数据。研究显示,在54名二线及以上治疗的多发性骨髓瘤患者中,cevostamab 70mg和105mg剂量组的总体缓解率分别达到86%和88%,展现出卓越的抗肿瘤活性。
值得关注的是,该联合方案在安全性方面也表现良好,3级感染发生率低于30%。这一数据为直接推进III期临床试验提供了有力支持,也彰显了罗氏对该创新疗法的信心。
战略布局:跳过II期直指III期临床
罗氏决定跳过II期临床试验,直接将cevostamab推进至III期阶段,这一战略决策在业内引发广泛关注。该举措既体现了公司对现有数据的充分信心,也包含一定的风险考量,因为FcRH5靶点的有效性尚未在大型临床试验中得到完全验证。
罗氏全球肿瘤与血液学开发负责人Charles Fuchs指出,FcRH5在“几乎100%”的骨髓瘤细胞上都有表达,但由于该靶点与其他FcRH家族成员相似,药物开发一直面临挑战。目前该领域竞争对手较少,仅有传奇生物和Moderna的少数资产处于早期试验阶段。
市场前景:差异化竞争寻求突破
随着包含Darzalex等抗CD38抗体的四联疗法在一线治疗中的普及,复发/难治性多发性骨髓瘤治疗领域存在巨大的未满足临床需求。尽管竞争激烈,cevostamab凭借其新颖的作用机制和良好的疗效安全性特征,有望在市场中占据独特地位。
Fuchs强调,cevostamab有望成为“跨行业多发性骨髓瘤疗法的理想合作伙伴”,公司正与多家潜在合作企业积极探讨联合治疗方案。这种开放的合作态度,结合药物本身的创新性,为cevostamab未来的商业化前景增添了更多可能性。
cevostamab的快速推进体现了罗氏在血液肿瘤领域的战略雄心。随着III期临床试验的即将启动,这一创新疗法有望为多发性骨髓瘤患者提供新的治疗选择,同时也将验证FcRH5作为新兴靶点在肿瘤免疫治疗中的价值。