罗氏集团宣布,欧盟委员会已正式批准皓罗华®(莫妥珠单抗)皮下注射剂附条件上市许可,用于治疗经过两次或以上全身系统治疗后复发或难治性滤泡性淋巴瘤的成年患者。这一创新剂型将治疗时间从传统静脉输注的2-4小时大幅缩短至约一分钟,为患者提供了更便捷的治疗选择。
剂型革新:治疗时间从数小时缩短至一分钟
皓罗华®皮下注射剂的获批标志着滤泡性淋巴瘤治疗便利性的重大飞跃。与传统静脉输注需要2-4小时相比,新型皮下注射仅需约一分钟即可完成给药。这一突破性进展显著减轻了患者的治疗负担,使治疗可以在门诊环境中便捷进行,极大提升了患者的生活质量。
罗氏制药相关负责人表示:“皓罗华®本身就具有固定疗程给药的优势,现在一分钟皮下注射的新选择,更好地帮助淋巴瘤患者满足临床治疗需求。开发新剂型一直是我们为患者提供更加便捷和高效治疗体验承诺的重要部分。”
疗效确证:持久缓解改善长期预后
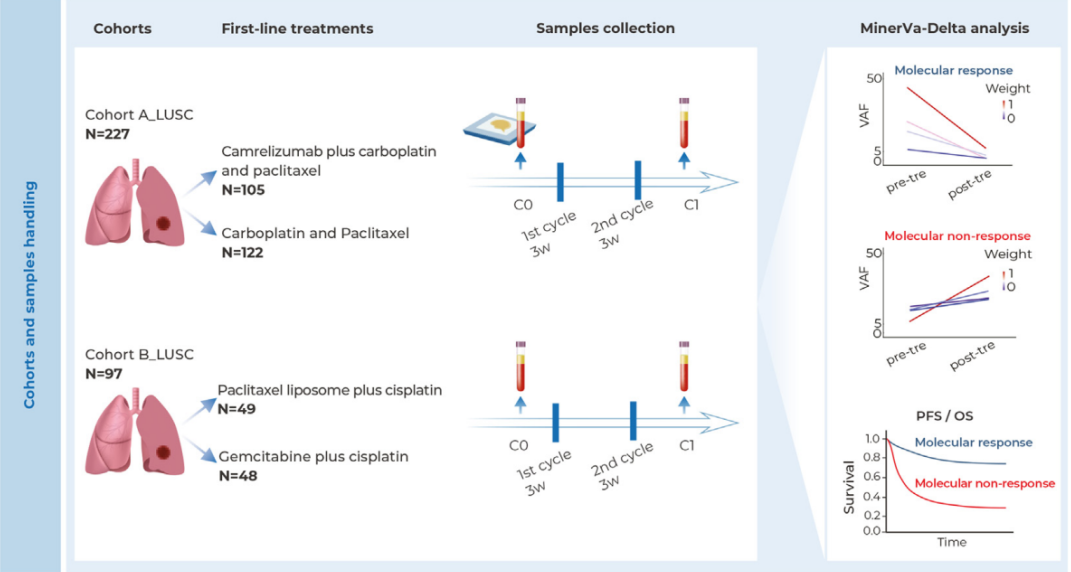
此次批准基于I/II期GO29781研究的结果,该研究证实皓罗华®皮下注射剂与静脉注射相比具有药代动力学非劣效性,安全性数据与既往研究一致,未发现新的安全性问题。
值得关注的是,皓罗华®静脉注射剂作为首个获批用于三线及后续滤泡性淋巴瘤治疗的双特异性抗体,已展现出卓越的长期疗效——57%达到完全缓解的患者在五年后仍保持疾病缓解状态。皮下注射剂型在保持相同疗效的同时,进一步提升了给药便利性。
疾病挑战:滤泡性淋巴瘤治疗需求迫切
滤泡性淋巴瘤是一种常见的惰性非霍奇金淋巴瘤,其在每次复发时都会变得更难治疗。皓罗华®在三线及更后线治疗中能够为患者带来更加深入和持久的疾病缓解,填补了重要的临床治疗空白。
目前,涉及皓罗华®皮下注射剂的多项研究正在进行中,包括MorningLyte试验,该试验正在探索皓罗华®皮下注射剂联合来那度胺治疗先前未接受过治疗的滤泡性淋巴瘤患者。这些研究将进一步拓展该药物的临床应用前景。
皓罗华®与高罗华®共同构成了罗氏行业领先的CD20xCD3双特异性抗体产品组合。公司表示将继续探索这些药物在不同疾病领域和治疗线中的新配方和组合,以改善患者体验并提供更多治疗选择。