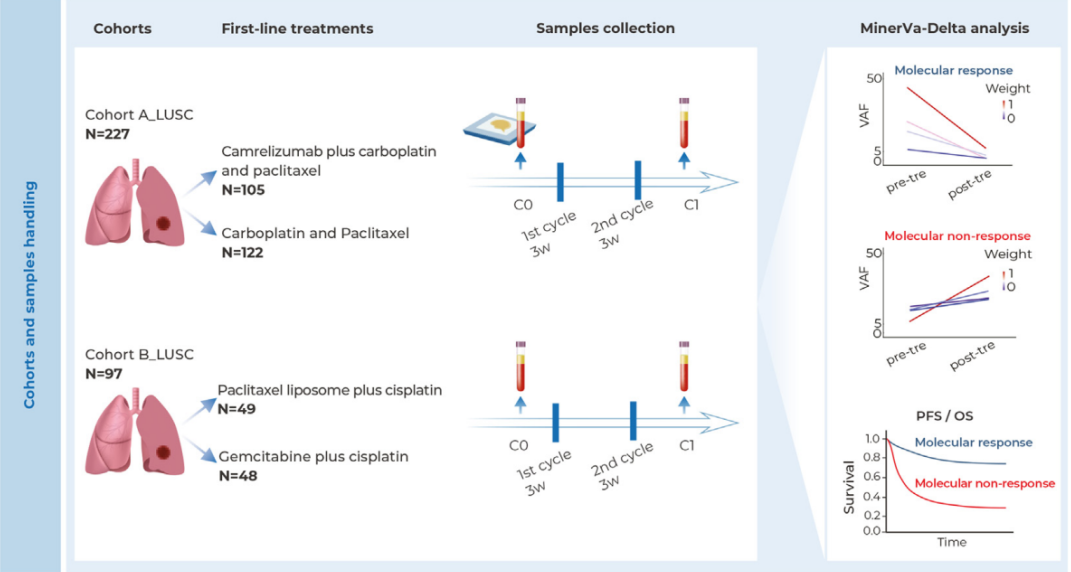
美国食品药品监督管理局近日宣布,首次依据其新设立的“局长国家优先审评券”试点计划,批准了一款药物——由USAntibiotics公司生产的缓释抗生素Augmentin XR。该审批仅用时约两个月,远低于常规10至12个月的审评周期,标志着这一旨在强化美国本土供应链的快速审评机制正式落地。

审批加速:两个月完成审评,彰显计划效率
FDA在12月9日的声明中强调,此次对Augmentin XR的审评“仅用两个月即完成”,是该类药物申请审评时间的“大幅缩短”。CNPV计划于今年6月推出,旨在向“目标符合美国国家优先事项”的企业发放有限数量的加速审评券。持券企业可将新药申请的审评时间缩短至1至2个月。
截至目前,FDA已发放了15张此类审评券。此次获批的Augmentin XR因其“通过在美国本土工厂提升产能来加强美国药品供应链”,被认定为与CNPV计划的“国家健康优先事项高度契合”。FDA同时指出,该批准有望帮助缓解美国国内抗生素短缺问题。
政策背景:应对供应链脆弱与药物短缺
FDA在声明中提及,过去二十年来美国抗生素短缺情况日益加剧,主要原因在于脆弱的原料药供应链和“临床需求的意外激增”。重建本土药品制造基础已成为本届政府的医疗政策重点之一,此前通过关税等措施推动产业进行本土生产投资。
疑问尚存:具体审批内容有待澄清
然而,此次批准也引发了一些疑问。根据FDA记录,葛兰素史克早在2002年就已获Augmentin XR的批准,但该药后来停产。USAntibiotics作为该药市场权益的当前持有者,曾在2022年获得FDA对该产品的批准,并于2024年进行了两次标签更新。目前尚不明确此次CNPV审评券具体针对的是哪些审评内容。截至发稿,美国卫生与公众服务部及USAntibiotics均未对置评请求作出回应。
此次审批是CNPV计划下的首次实践,其长期效果以及对促进本土生产、保障供应链稳定的实际影响,仍有待后续观察。