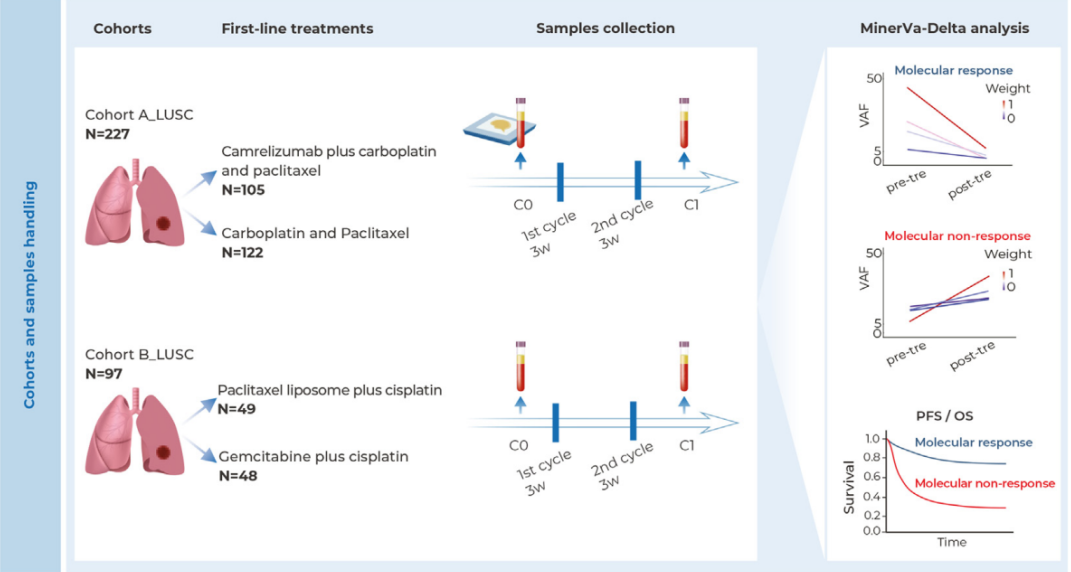
美国食品药品监督管理局近日主动授予强生公司“局长国家优先审评券”,用于加速其多发性骨髓瘤联合疗法(Tecvayli联合Darzalex)的上市审批流程。此举意味着该药物的新适应症申请有望在提交后1至2个月内获得决定,远快于常规10个月的审评周期。

审批加速:FDA主动出击,数据发布次日即联系企业
根据FDA局长马丁·马卡里博士12月15日的声明,在ASH年会数据公布后,FDA高层在数小时内完成研究报告审阅并咨询内部专家,次日即主动联系强生讨论授予优先审评券事宜。马卡里强调:“当一项疗法展现出卓越的试验结果时,我们有责任为患者迅速行动。”
值得注意的是,强生最初并未主动申请CNPV。此次FDA的“前瞻性”授予,体现了监管机构对突破性疗效数据的积极响应。
疗效数据:死亡风险降低54%,PFS优势达83%
此次加速审评基于强生在ASH年会上公布的MajesTEC-3三期试验数据。该研究显示,在既往接受过1-3线治疗的多发性骨髓瘤患者中,Tecvayli联合Darzalex方案相比传统联合方案(Darzalex联合地塞米松及泊马度胺或硼替佐米),将死亡风险降低54%,无进展生存期优势高达83%。
强生已于12月9日提交该适应症的上市申请,并已进入实时肿瘤学审评通道。公司此前在数据摘要中称这些结果为“前所未有的”。
行业意义:监管创新提速突破性疗法上市
此次事件标志着FDA正通过CNPV等创新审评机制,积极推动具有显著临床价值的疗法加速惠及患者。随着肿瘤治疗领域创新不断涌现,这种基于卓越数据、监管主动介入的审评模式,有望为更多突破性疗法开辟快速通道,重塑药物审批的速率与效率标准。